Właściwości wody: izotopy i budowa molekularna.
Właściwości wody 1: ogólne
Właściwości wody 2: właściwości fizyczne i chemiczne
Skład izotopowy wody
Woda jest mieszaniną różnych kombinacji izotopów tlenu i wodoru, różniących się od siebie liczbą neutronów związanych z protonami w jądrze.
1H,2 H (deuter)3H (tryt)
16O, 17O,18O.
Stosunki izotopowe są następujące:
W przypadku wodoru:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
Tryt jest niestabilnym pierwiastkiem, jego okres półtrwania wynosi 12,5 lat.
Dla tlenu:
18O/16O = 1 / 500
17O/16O = 1 / 2500
Główne rodzaje molekularne 4 i ich częstotliwości są następujące:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = bardzo słaby
Różne izotopy indukują różnice we właściwościach fizycznych cząsteczek, w szczególności ich gęstości, ale właściwości chemiczne pozostają takie same.
Ciężka woda D.2O istnieje w stanie naturalnym, ale w bardzo
Niska. Aby uzyskać znaczną jego ilość, konieczne jest opanowanie technik separacji izotopów: było to jedno z podstawowych wyzwań podczas ostatniej wojny światowej, aby przygotować broń atomową.
Skład izotopowy składników chemicznych wody służy do oceny parametrów termodynamicznych, takich jak temperatura;
raport 18 O/16O lód z czap polarnych i woda z kopalnych wód podziemnych dostarczają informacji o klimacie w przeszłości.
Odparowanie wody oceanicznej odbywa się przy frakcjonowaniu izotopowym: lekki izotop tlenu wyparowuje zamiast ciężkiego izotopu. Oceany są bogatsze w ciężkie izotopy niż woda z chmur i opadów.
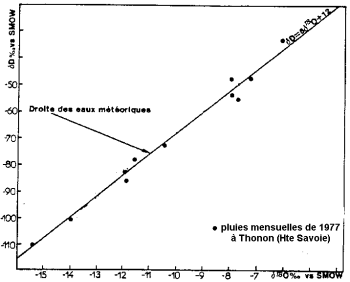
Stabilna zawartość izotopów w opadzie (za Blavoux i Letolle, 1995).
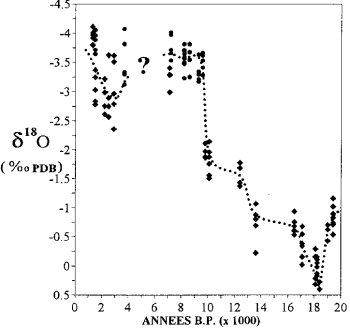
Zmienność zawartości izotopów tlenu w koralowcach Majotty (za Casanova i in., 1994).
Struktura cząsteczki
Atomy wodoru i tlenu łączą swoje elektrony, tworząc kompletną warstwę podobną do warstwy neonu. Rzeczywiście, atomowi tlenu brakuje 2 elektronów do uzupełnienia swojej powłoki elektronicznej, to 2 atomy wodoru go dostarczają. Utworzona cząsteczka H2O jest stabilna.
Tlen: protony 8 + neutrony 8
Wodór: 2 (2 * (proton 1 + neutron 1))
Łącznie: protony 10 równoważące ładunki elektronów 10.
Jądra wodoru są rozmieszczone po jednej stronie tlenu, tworząc charakterystyczną „głowę Miki” (wodór to uszy).
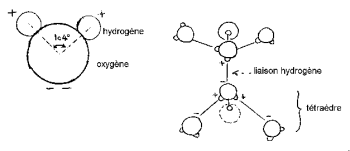
Kąt HOH wynosi 104,474 ° (charakterystyczny dla geometrii czworościennej). Odległość między tlenem a atomem wodoru jest bliska 1 A ° (0,95718 A °) w parze. Efektywna średnica cząsteczki jest rzędu 2,82 A °.
W tej małej cząsteczce ładunki elektryczne są nierównomiernie rozłożone. Elektrony są silniej przyciągane do atomu tlenu niż do atomu wodoru. W pobliżu jąder wodoru znajdują się 2 centra ładunków dodatnich i 2 centra ładunków ujemnych w pobliżu jądra tlenu. Ta nierównowaga w rozkładzie ładunków, w połączeniu z nieliniową geometrią cząsteczki wody, objawia się istnieniem silnego elektrycznego momentu dipolowego. Cząsteczka wody jest polarna; zachowuje się jak dipol elektryczny, który może w ten sposób wiązać się z innymi cząsteczkami polarnymi. Rzeczywiście, cząsteczki wody można wprowadzić między jony składowe kryształu, kierując w ich stronę ich część o przeciwnym ładunku elektrycznym. Przyciąganie krystalicznych jonów jest znacznie osłabione, a spójność kryształu jest zmniejszona, co ułatwia jego rozpuszczanie. Polarne właściwości cząsteczki wody wyjaśniają technikę ogrzewania mikrofalowego. Rzeczywiście, spolaryzowana cząsteczka orientuje się w odniesieniu do pola elektrycznego; jeśli to się zmienia, cząsteczka podąża za zmianą orientacji. Od pewnej częstotliwości, kilku GHz dla wody, ruchy cząsteczek wytwarzają ciepło poprzez tarcie. Piece domowe zwykle działają z częstotliwością 2,45 GHz, czyli UHF.
Trzy jądra cząsteczki nie są stacjonarne, poruszają się względem siebie, cząsteczka wibruje i skręca. W wodzie ciekłej cząsteczki mają tendencję do łączenia się: głowy Mickeya łączą ucho z brodą za pomocą wiązania wodorowego. Rzeczywiście, z 3 obwodowych elektronów tlenu tylko 8 są zaangażowane w wiązania kowalencyjne z atomami wodoru. Pozostałe 4 elektrony są pogrupowane w 4 pary zwane dubletami wolnych elektronów. Każdy z tych ujemnie naładowanych elektrycznie dubletów może tworzyć wiązanie elektrostatyczne z dodatnio naładowanym atomem wodoru z pobliskiej cząsteczki wody. Wiązanie wodorowe, które jest stabilne w temperaturze pokojowej, jest jednak kruche w porównaniu z wiązaniem kowalencyjnym. W cząsteczce wody geometria utworzona przez kierunek 2 wiązań kowalencyjnych i 2 wolnych dubletów elektronowych jest zbliżona do geometrii czworościanu, którego centrum zajmują jądra tlenu.
Jednak nadal niedokładnie poznana jest duża struktura cząsteczki wody. Widma dyfrakcji rentgenowskiej i neutronów dostarczają 2 główne wartości: sygnał odpowiadający 1 A °, odległość między jądrami wodoru i tlenu oraz wartość od 2,84 do 4 A ° zmieniająca się w zależności od temperatury i odpowiadająca odległości między 2 jądrami tlenu. Dyfraktometria rentgenowska umożliwia również poznanie średniej liczby cząsteczek na jednostkę objętości cieczy znajdującej się w odległości R od danej cząsteczki. Cząsteczka wody ma średnio 4,4 sąsiadów, co sugeruje siatkę czworościenną. Oprócz cząsteczek połączonych wiązaniami wodorowymi istnieją inne niezwiązane cząsteczki, co może wyjaśniać, dlaczego liczba sąsiednich cząsteczek jest nieco większa niż 4, a nie 4 dokładnie, jak narzuciłby ścisły tetraedryczny stan skrystalizowany. Sieć krystaliczna cząsteczek połączonych wiązaniami wodorowymi utworzyłaby wnęki, w których znajdowałyby się niezwiązane cząsteczki. Inna hipoteza opiera się na zniekształceniu wiązań wodorowych. Ta ostatnia, pierwotnie liniowa, to znaczy z ustawionymi atomami O - HO, może skręcać się w różnym stopniu i pozwalać cząsteczkom, które są bardziej odległe niż bliscy sąsiedzi, zbliżać się do cząsteczki centralnej.
Modele teoretyczne zostały niedawno opracowane przy użyciu potężnych komputerów. Wskazują, że około 80% cząsteczek wody jest zaangażowanych w 3 lub 4 wiązania wodorowe; z drugiej strony wykluczają obecność niezwiązanych cząsteczek. Modelowanie komputerowe sugeruje, że gdy woda się ochładza, sieci cząsteczek coraz bardziej przypominają sześciokąty podobne do tych w lodzie.
Stan stały odpowiada ściślejszemu układowi krystalicznemu. Pod zwykłym ciśnieniem lód ma strukturę sześciokątną. W niskiej temperaturze (poniżej -80 ° C) może mieć strukturę sześcienną. Ładunki elektryczne mogą poruszać się w sieci krystalicznej i powodować defekty kryształów typu jonowego: uwodniony proton H3O + i jon hydroksylowy OH-. Sieć krystaliczna lodu nie odpowiada możliwie najbardziej zwartemu układowi cząsteczek. Po fuzji defekty zapadają się, ponieważ wiązania wodorowe pękają i cząsteczki zbliżają się do siebie: gęstość wzrasta do maksimum w 4 ° C. Następnie w wodzie ciekłej wzrost temperatury odpycha cząsteczki i zmniejsza się gęstość.
Aby dowiedzieć się więcej, referencje i bibliografia:
Blavoux B. i Letolle R. (1995) - Wkład technik izotopowych w wiedzę o wodach podziemnych. Geochronics, 54, s. 12-15.
Caro P. (1990) - Właściwości fizyczne i chemiczne wody. Wielka księga o wodzie, La Villette, s. 183-194.
Eagland D. (1990) - Struktura wody. The Research, 221, s. 548-552.
Maidment DR (1992) - Podręcznik hydrogeologii. Mc Graw Hill.
Casanova J., Colonna M. and Djerroud K. (1994) - Geoprospective - paleoclimatology. Rapp. naukowiec. BRGM, s. 76-79.

